先声药业引进的创新CDK4/6抑制剂获批,支持治疗小细胞肺癌
今日(7月13日),中国国家药监局(NMPA)官网最新公示,先声药业引进的骨髓保护创新药注射用曲拉西利(trilaciclib)新药上市申请已正式获批。曲拉西利是一款CDK4/6抑制剂。根据先声药业早前新闻稿,该药此次获批的适应症为:在接受含铂类药物联合依托泊苷方案的广泛期小细胞肺癌患者中预防性使用,以降低化疗引起的骨髓抑制的发生率。

在美国,曲拉西利曾获FDA授予的突破性疗法认定和优先审评资格,并已于2021年2月获批上市,用于降低广泛期小细胞肺癌患者在接受某些类型化疗时出现的骨髓抑制频率。FDA曾在新闻稿中指出,对于广泛期小细胞肺癌患者来说,保护骨髓功能有助于使他们的化疗更加安全,并允许他们按计划完成疗程。曲拉西利的获批将给患者带来新的治疗选择,可以减少一种常见有害化疗副作用的发生。
在中国,先声药业于2020年8月与G1 Therapeutics达成授权合作,获得了曲拉西利在大中华地区所有适应症的开发和商业化权益。2021年11月,先声药业宣布在中国递交曲拉西利的新药上市申请,首个适应症为:在接受含铂类药物联合依托泊苷方案的广泛期小细胞肺癌患者中预防性使用,以降低化疗引起的骨髓抑制的发生率。随后,该申请又被中国国家药品监督管理局药品审评中心(CDE)纳入优先审评。
公开资料显示,用于支持曲拉西利中国上市申请的数据包括了先声药业及其合作伙伴在境内外开展的多项临床研究的结果。其中,3项海外临床研究已证实了曲拉西利的有效性,研究评估了曲拉西利在广泛期小细胞肺癌接受化疗的患者中前四个化疗周期里对单系和多系骨髓抑制的保护作用。根据2022年在美国临床肿瘤学年会(ASCO)上公布的事后分析数据,与安慰剂相比,无论是一线治疗还是二线及以上治疗,接受曲拉西利的患者均较少发生单系和2、3系骨髓抑制事件,表明广泛期小细胞肺癌患者在治疗前给予曲拉西利可有效防止骨髓抑制。
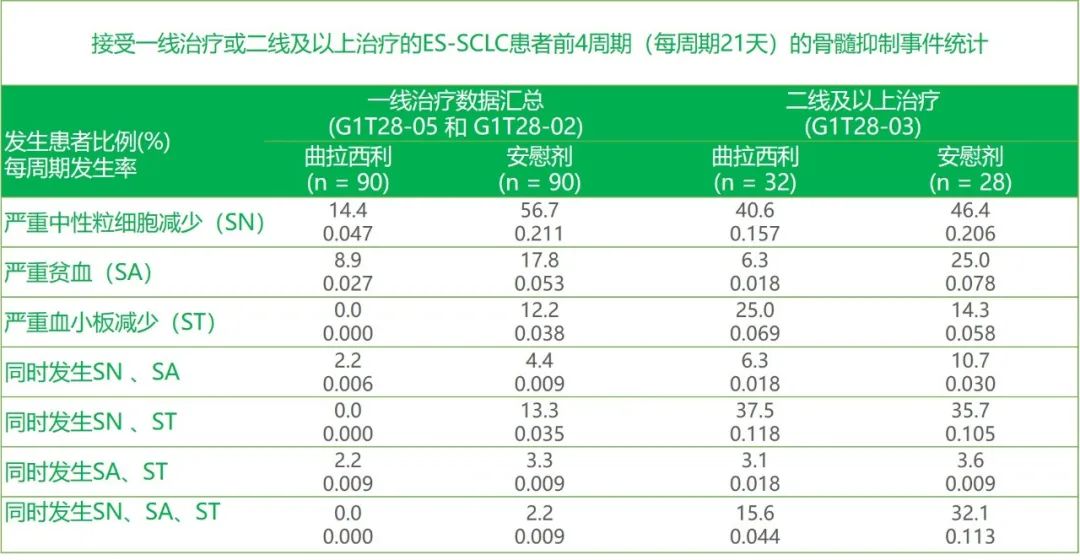
曲拉西利3项研究的事后分析数据
今年2月,先声药业宣布曲拉西利针对广泛期小细胞肺癌的中国注册3期临床试验达到主要研究终点。研究证实,在中国小细胞肺癌患者中,曲拉西利可以显著缩短第一周期严重中性粒细胞降低持续时间。此外,研究还表明,曲拉西利在中国患者与海外患者具有一致的药物代谢动力学(PK)特征和临床获益趋势,且未发现新的安全性信号。





